La Agencia Europea de Medicamentos inicia la evaluación de Sputnik V
09:07 GMT 04.03.2021 (actualizado: 14:39 GMT 09.08.2021)
© Sputnik / Valery Melnikov
/ Síguenos en
MOSCÚ (Sputnik) — La Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) comenzó la evaluación continua de la vacuna contra COVID-19 rusa Sputnik V, informó el Fondo Ruso de Inversión Directa (RDIF).
"El RDIF anuncia que el Comité de Medicamentos de Uso Humano [CHMP, pos sus siglas en inglés] de la EMA inicia la evaluación continua de la vacuna contra el coronavirus rusa Sputnik V", comunicó el Fondo.
Se precisa que la EMA decidió lanzar el procedimiento tras haber examinado los resultados de los estudios de laboratorio y ensayos clínicos del fármaco en adultos.
"La EMA evaluará si la vacuna Sputnik V corresponde a las normas de la Unión Europea en términos de eficacia, seguridad y calidad", señaló el RDIF.
El director del RDIF, Kiril Dmítriev, saludó el comienzo del proceso: "La autorización de la EMA permitirá garantizarles el acceso a la vacuna Sputnik V a 50 millones de ciudadanos de la Unión Europea a partir de junio de 2021". Indicó que la EMA cuenta con todos los datos necesarios sobre el fármaco y subrayó que la vacuna rusa es capaz de hacer una contribución importante para salvar millones de vidas en toda Europa.
"La colaboración en cuanto a las vacunas debe estar por encima de la política y la cooperación con la EMA es un ejemplo excelente que confirma que solo a través de unir las fuerzas se puede vencer la pandemia", recalcó Dmítriev.
Asimismo, el RDIF precisó que la vacuna Sputnik V ya ha sido registrada en 42 países y ha recibido un fuerte reconocimiento mundial, incluido el hecho de que ya ha sido registrada y utilizada en ocho países europeos, entre ellos dos de la UE, a pesar de los intentos de la Comisión Europea de no permitirlo.
El fondo solicitó el registro en enero y las declaraciones de que supuestamente no lo había solicitado eran erróneas y otro intento de atacar a Sputnik V. El inicio oficial de la revisión por la EMA confirma que la solicitud de registro se presentó antes y que el RDIF está totalmente abierto a proporcionar toda la información necesaria a la agencia europea para el registro.
El fondo precisó que "ve constantes intentos por parte de la Comisión Europea y de las fuerzas que quieren contener a Rusia e impedir los éxitos rusos: los intentos de politizar la vacuna rusa e intentos de atacarla".
Al mismo tiempo, subrayó que las encuestas muestran que la Sputnik V es una de las vacunas más deseadas.
En febrero el director del RDIF declaró que los suministros del Sputnik V a la UE pueden empezar como más temprano en mayo o junio, después de que termine la parte fundamental de la vacunación masiva en Rusia.
A su vez, la propia EMA precisó que la evaluación continua permanecerá en marcha hasta que estén disponibles suficientes pruebas para realizar la solicitud formal de autorización de comercialización.
El director regional de la Organización Mundial de la Salud (OMS) para Europa, Hans Henri P. Kluge, saludó el lanzamiento de la evaluación continua de Sputnik V.
"Creemos que es una buena noticia, hemos dicho antes que la Federación de Rusia tiene un pasado sólido y probado en el desarrollo, la fabricación y el uso de vacunas", expresó Kluge.
En este contexto, recordó que Rusia en gran medida contribuyó a la lucha contra la poliomielitis y la fiebre amarilla.
"Necesitamos desesperadamente ampliar nuestra cartera de vacunas, por lo que veo eso (la evaluación de Sputnik V) como un avance muy bienvenido", puntualizó el director regional.

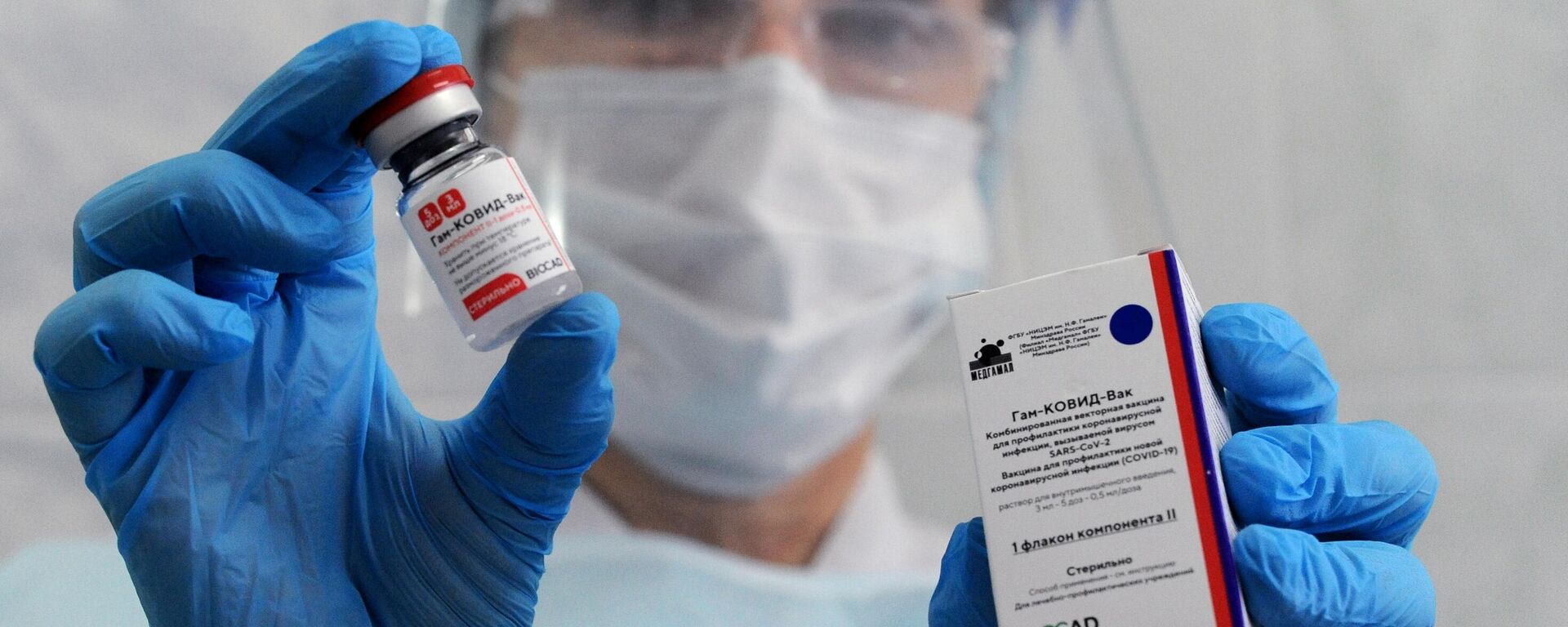
La vacuna rusa Sputnik V
Sputnik V, registrada en Rusia el 11 de agosto de 2020, consta de dos dosis que se aplican con un intervalo de 21 días. La primera se basa en el adenovirus humano tipo 26 y la segunda, en el adenovirus humano recombinante del tipo 5.
A principios de febrero, la revista científica británica The Lancet publicó los resultados provisionales de la tercera fase del ensayo clínico de la vacuna rusa, que confirmaron una seguridad y eficacia del 91,6%.
La vacuna está aprobada en 70 países de Europa, Asia, África y América, entre ellos Argentina, Bolivia, México y Venezuela.